Die wunderbare Welt der Kristalle
Kristalle sind wunderschön und gerade vor Weihnachten sieht man auf vielen Weihnachtsmärkten Stände, an denen man Kristalllampen und anderen Schmuck käuflich erwerben kann. Genau der richtige Zeitpunkt, um Kristalle und deren Bildung einmal von der chemischen Seite aus zu betrachten! Im Rahmen mehrerer Nachmittagstermine hat vor den Ferien eine Projektgruppe aus den Klassenstufen 7 und 11 Kristalle gezüchtet und dabei viel Geduld mitgebracht. Margo aus der 11a stellt hier die Ergebnisse und Erfahrungen vor. Die Fachschaft Chemie hofft, auch in Zukunft weitere Kleinprojekte für besonders interessierte Schüler:innen anbieten zu können. Wer zu Hause selbst Kristalle züchten möchte, kann hierzu eine gesättigte Kochsalzlösung herstellen und diese langsam an einem ruhigen, kühlen Ort verdunsten lassen. Warum hier Geduld gefragt ist, erfahrt ihr im Bericht.
Bericht von Margo:
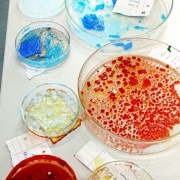
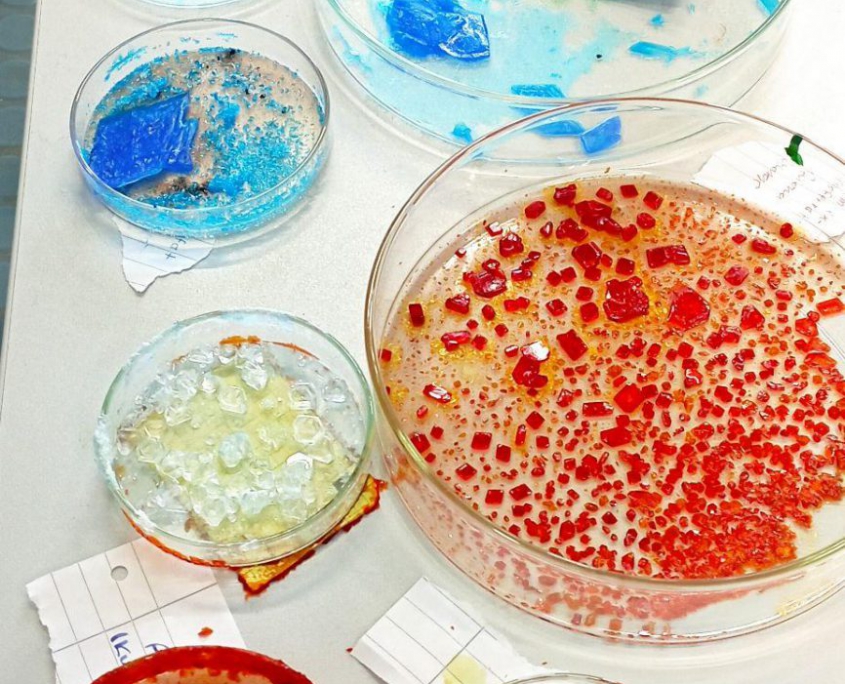
„Das Züchten von Kristallen ist eine faszinierende Tätigkeit, bei der schimmernde Strukturen entstehen, die nicht nur lehrreiche Erkenntnisse bieten, sondern auch ästhetisches Vergnügen. In unserem Experiment haben wir uns an der Kristallzucht versucht, mit 3 verschiedenen Salzen: Natriumchlorid, Kalium-Aluminium-Sulfat und Kupfersulfat.
Das jeweilige Salz wird zuerst in einem Becherglas aufgelöst. Es wird jeweils so viel Salz aufgelöst, bis sich kein Salz mehr im erwärmten Wasser löst. Das Salz besteht aus vielen kleinen Teilchen, die durch Anziehungskräfte miteinander verbunden sind. Den Verbund von unzähligen kleinen Teilchen können wir als Salzkorn erkennen. Das flüssige Wasser besteht ebenfalls aus diesen Teilchen, die dicht aneinander angeordnet sind und sich bewegen, durch die Teilchenbewegung stoßen die Wasserteilchen auf den Verbund von Salzteilchen. Nicht nur zwischen den gleichen Teilchen wirken diese Anziehungskräfte, sondern auch zwischen unterschiedlichen. Die Wassermoleküle trennen die Salzteilchen und bilden eine Hülle um das abgetrennte Salzteilchen. Sind alle Salzteilchen von Wassermolekülen umgeben, ist der Stoff aufgelöst. Mit einer Heizplatte und einem Spatel zum Umrühren kann man diesen Vorgang beschleunigen. Da die Wärmeenergie die Teilchen beschleunigt und der oben beschriebene Vorgang schneller vonstattengeht. Ist alles aufgelöst, gibt es nun zwei Varianten, Kristalle daraus zu erzeugen.
1. Abkühlen
Beim Abkühlen werden den Teilchen Energie entzogen und sie bewegen sich langsamer. Dadurch können die Anziehungskräfte zwischen den Salzteilchen besser wirken. Sie verbinden sich wieder und sinken als Kristalle auf den Boden.
2. Verdunsten
Das Gefäß mit den gelösten Salzen wird offen hingestellt. Durch die unterschiedlichen Siedetemperaturen der Stoffe verdunstet das Wasser. Im Laufe dieses Prozesses führt das zu einer Übersättigung, das heißt, es sind mehr Teilchen des Salzes vorhanden als Wasser und die Salzteilchen verbinden sich miteinander. Das Wachstum dieser Kristalle ist beendet, wenn alles Wasser verdunstet ist.
Am Ende beider Prozesse erhält man Impfkristalle.
Der Impfkristall wird wiederum in eine stark übersättigte Lösung gehängt. Das ist wichtig, da sich sonst der Kristall wieder im Wasser auflösen würde. Da die Lösung übersättigt ist, wächst der Kristall, da sich die überschüssigen Teilchen, die nicht im Wasser gelöst werden konnten, an den Kristall hängen. Für ein möglichst gleichmäßiges Wachstum ist es wichtig, dass der Impfkristall vollständig in der Lösung hängt und dabei das Gefäß nicht berührt. Die Lösung wird nun an einen ruhigen Ort gestellt. Es wird so lange Salz nachgefüllt, bis der Kristall die gewünschte Größe gewonnen hat.
Man wird unterschiedliche Formen und Größen feststellen, die von Faktoren wie Tiefe des Gefäßes und Temperatur abhängen.
In der bezaubernden Welt der Salzkristall Zucht trifft Wissenschaft auf Kunst und feiert die Schönheit der Natur. Ob zu Bildungszwecken, zur kreativen Erforschung oder einfach nur zum Vergnügen – diese zugängliche und faszinierende Aktivität sorgt bei Menschen allen Alters für Faszination.“